NIVELACIÓN SEGUNDO PERIODO - BLOGGER

INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
10.2
2018
INTRODUCIR
En este trabajo vamos a encontrar que son las ecuaciones químicas como desarrollar un proceso ecuaciones química, y vamos a ver unos ejemplos de ecuaciones químicas como podemos ver que si un lado tiene un numero de átomos el otro igual.
OBJETIVOS
- Conocer como desarrollar una ecuación química
- hacer balanceo por oxido reducción
- conocer mas de ecuaciones quimicas
- conocer los números de oxidación
- conocer os métodos de reducción y oxidación
Ecuación química
Es la representación gráfica o simbólica de una reacción química que muestra las sustancias, elementos o compuestos que reaccionan (llamados reactantes o reactivos) y los productos que se obtienen. La ecuación química también nos muestra la cantidad de sustancias o elementos que intervienen en la reacción, en sí es la manera de representarlas.
Reacción química
Es también llamado cambio químico y se define como todo proceso químico en el cual una o más sustancias sufren transformaciones químicas. Las sustancias llamas reactantes se combina para formar productos.
En la reacción química intervienen elementos y compuestos. Un ejemplo de ello es el Cloruro de Sodio (NaCl) o comúnmente conocido como "sal de mesa" o "sal común".
Balanceo de ecuaciones químicas
Una reacción química es la manifestación de un cambio en la materia y la isla de un fenómeno químico. A su expresión gráfica se le da el nombre de ecuación química, en la cual, se expresan en la primera parte los reactivos y en la segunda los productos de la reacción.
A + B C + D
Reactivos Productos
X
Para equilibrar o balancear ecuaciones químicas, existen diversos métodos. En todos el objetivo que se persigue es que la ecuación química cumpla con la ley de la conservación de la materia.

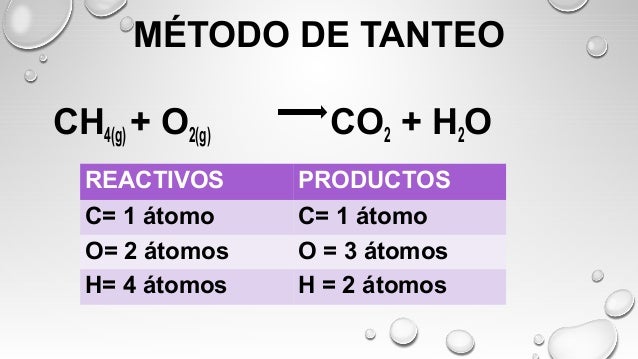
BALANCEO POR TANTEO
Balancear una ecuación química es igualar el número y clase de átomos, iones o moléculas reactantes con los productos, con la finalidad de cumplir la ley de conservación de la masa.
Para conseguir esta igualdad se utilizan los coeficientes estequiométricos, que son números grandes que se colocan delante de los símbolos o fórmulas para indicar la cantidad de elementos o compuestos que intervienen en la reacción química.
No deben confundirse con los subíndices que se colocan en los símbolos o fórmulas químicas, ya que estos indican el número de átomos que conforman la sustancia.
Si se modifican los coeficientes, cambian las cantidades de la sustancia, pero si se modifican los subíndices, se originan sustancias diferentes.
BALANCEO POR OXIDO REDUCCIÓN
El método del cambio de los números de la oxidación es relativamente sencillo, y es un modo fácil de equilibrar las ecuaciones redox. Se basa en el hecho de que el aumento de los números de la oxidación de los reactantes que han sido oxidados tiene que ser idéntico a la disminución de los números de oxidación de los reactantes que han sido reducidos.

Instrucciones para equilibrar las ecuaciones redox
Paso 1. Se escribe una reacción desequilibrada
Paso 2. Se desmonta la reacción redox a las reacciones parciales
a) Se determinan los números de la oxidación de cada átomo respectivo.
b) Se identifican los pares redox en la reacción
c) Se combinan los pares redox en dos reacciones parciales
Paso 3. Se equilibran los átomos en las ecuaciones parciales
a) Se equilibran todos los átomos excepto del H y del O
b) Se equilibran las cargas añadiendo H+ o OH-
b) Se equilibran los átomos del oxígeno añadiendo H2O
Paso 4: Se iguala el número de los electrones perdidos y recibidos en las reacciones parciales
Paso 5: Se suman las ecuaciones parciales
Paso 6: Se acorta la ecuación
Y al final, siempre se verifica el equilibrio de las cargas y de los elementos.
CONCLUSIONES
En este trabajo nos damos cuenta que es y como se hace un balanceo de ecuaciones químicas por oxido reducción y por tanteo y como podemos solucionar y que es una ecuación química y como podemos balancearla por medio de unos ejemplos que vemos de ecuación por tanteo
WEB GRAFÍA


























Comentarios
Publicar un comentario