PH
PH

INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
ÁREA DE CIENCIAS NATURALES
IBAGUE
2018
INTRODUCCIÓN
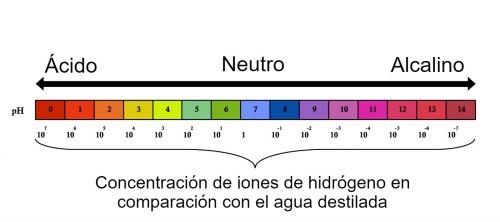
El ph expresa la concentración efectiva de iones H en solución del suelo en términos de peso equivalente de litro por solución. El patrón de concentración siempre es PH de agua pura, en la cual la concentración de iones H es (10-7)equivalentes por litro, y para obviar el uso de tantos decimales se ha definido al PH como logaritmo de valor de concentración.
OBJETIVOS
- el objetivo principal de este informe es relacionar alguno de los conceptos y técnicas aprendidas en clases sobre reacciones químicas en soluciones acuosas, aplicando técnicas de medición de pH e identificación de ácidos y bases,
- conocer el grado de alcalinidad y acidez de nuestra agua
- aprender el funcionamiento de el pH-metro en las muestras
-determinar la acidez o la alcalinidad de una solución expresado en pH, de manera aproximada por medio de indicadores y exacta.
MARCO TEÓRICO
química
para evaluar la acidez o alcalinidad de una sustancia por lo general en su
estado líquido (también se puede utilizar para gases). Se entiende por acidez
la capacidad de una sustancia para aportar a una disolución acuosa iones de
hidrógeno, hidrogeniones (H*) al medio. La alcalinidad o base aporta hidroxilo
OH- al medio. Por lo
tanto, el pH mide la concentración de iones de hidrógeno de una sustancia, En
1909, el químico danés Sorensen definió el potencial hidrógeno (pH ) como el logaritmo negativo de la
concentración molar ( más exactamente de la actividad molar ) de los iones hidrógeno.
Esto es: pH=-log[H + ] Desde entonces, el término pH ha sido universalmente utilizado por la facilidad
de su uso, evitando asi el manejo de cifras largas y complejas. Por ejemplo,
una concentración de[H+]=1x10-8 M(0.00000001) es simplemente un pH de 8 ya que : pH= - log [10-8] 8.
· se define el pOH como el logaritmo negativo en base 10 de la actividad de los aniones hidroxilo ,o también en términos de concentración de éstos.
·
NaOH (Hidróxido de sodio)
El hidróxido
de sodio (NaOH) o hidróxido
sódico, también conocido como soda
cáustica o sosa cáustica, es un hidróxido cáustico usado en la industria (principalmente como una base química) en la fabricación de papel, tejidos, y detergentes. Además, se utiliza en la industria petrolera en la
elaboración de lodos de perforación base agua. A nivel doméstico, son
reconocidas sus utilidades para desbloquear tuberías de desagües de cocinas y
baños, entre otros.

·
HCL (Ácido
clorhídrico)
es una disolución acuosa del gas cloruro de hidrógeno (HCl). Es muy corrosivo y ácido. Se emplea comúnmente como reactivo químico y se trata de un ácido fuerte que se disocia completamente
en disolución acuosa. Una disolución concentrada de ácido clorhídrico tiene unpH inferior a 1; una disolución de HCl 0,1 M da un pH de 1

ROJO METILENO
El rojo
de metilo es un indicador de pH. (Fórmula: C15H15N3O2).
Actúa entre pH 4,2 y 6,3 variando desde rojo (pH 4,2) a amarillo (pH 6,3). Por lo
tanto, permite determinar la formación de ácidos que se producen durante la fermentación de un clorhidrato. El rojo de metilo se prepara con 0,1 g de
este reactivo en 1500 ml de metanol. Una reacción positiva (más o menos) indica que el microorganismo realiza una fermentación acidoláctica de la glucosa por la vía ácido-mixta.
MEDICIÓN DEL pH
El valor del pH se puede medir de forma precisa mediante un potenciómetro, también conocido como pH-metro hímetro/ o /pe ache metro/), un instrumento que mide la diferencia de potencial entre dos electrodos: un electrodo de referencia (generalmente de plata/cloruro de plata) y un electrodo de vidrio que es sensible al ion de hidrógeno.
El pH de una
disolución se puede medir también de manera aproximada empleando indicadores: ácidos
o bases débiles que presentan diferente color según el pH. Generalmente se
emplea un papel indicador, que consiste en papel impregnado con una mezcla de
indicadores cualitativos para la determinación del pH. El indicador más
conocido es el papel de litmus o papel tornasol.
Otros indicadores usuales son la fenolftaleína y
el naranja de metilo.
EJERCICIOS LABORATORIO









CONCLUSIONES
- Con la practica de el laboratorio realizada se pudo sacra diversas conclusiones:
1. el pH es el que indica en una solución que tan ácida, básica o neutra se encuentra, dependiendo de dicha concentración y los indicadores utilizados para estandardizar o titular
2. el pH-metro es el instrumento utilizado para medir cual pH y fue el que nos permitió saber el pH de cada una de las soluciones.
3. se pudo concluir que el pH es una sustancia colorida que cambia de color según sea ácido o básica
3. en conclusión al comparar los resultados del pH teórico y el pH experimental se pudo observar que los experimentales fueron mayores con respecto a los teóricos, eso debido a que se tubo ciertos problemas con el pH-metro ya que este no se encontraba cilibradi y a que el agua estaba muy alcalina .
WEBGRAFIA? Y PUDO CONSULTAR MAS MARCO TEÓRICO 4.0
ResponderEliminar