TITULACIÓN
TITULACIÓN
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
AREA DE CIENCIA NATURALES
IBAGUE
2018
INTRODUCCIÓN
Las reacciones ácido-base son reacciones de equilibrio homogéneo (neutralización) entre los iones, que se producen al estar en contacto un ácido con una base obteniéndose una sal mas agua.
Durante las operaciones rutinarias en el laboratorio así como en la de los análisis volumétricos son prácticamente mayor los problemas relacionados con la estequiometrìa, una de ellas es la normalidad que se define como el número de equivalentes de soluto por litro de solución.
La normalidad es útil porque el equivalente se obtiene de manera que un equivalente de un agente oxidante reaccione con un equivalente de un agente reductor, un mol de electrones adquiridos y un mol de electrones perdidos. De manera semejante.
Un equivalente de un ácido neutraliza completa y precisamente un equivalente de una base, puesto que un mol H+ reaccionará con un mol de OH-.
Esto significa que al mezclar volúmenes iguales de soluciones que tienen la misma normalidad llevara a una reacción completa entre sus solutos, un litro de ácido 1N neutralizará completamente un litro de base 1N porque un equivalente de ácido reaccionara con un equivalente de base.
Esta reacción se utiliza par averiguar la cantidad de ácido que posee una disolución a partir de una cantidad de base conocida, o viceversa.
Dicha técnica recibe el nombre de titilación por método volumétrico, volumetría ácido-base o reacción de neutralización.
Este método se realiza mediante una bureta que contiene una de las disoluciones y un matraz con la otra disolución, se vierte cuidadosamente el contenido el contenido de la bureta en el matraz hasta la neutralización de dicha solución.
El final de la titilación se nos advierte con un indicador suele cambiar de color, según exista un exceso de ácido o de base.
Cabe resaltar que en esta practica se utilizará fenoltaleìna (C20H14O4) como indicador.
OBJETIVOS
Preparar soluciones diluidas a partir de soluciones concentradas
Expresar la concentración de la solución final en unidades químicas y físicas
Determinar la concentración de una solución desconocida por titilación
MARCO TITULACIÓN
“PREPARACIÓN DE SOLUCIONES Y TITULACIONES”
Reacción química: las reacciones químicas suceden espontáneamente en el mundo que nos rodea; ejemplos son las que ocurren al encender un cerillo, al oxidarse un metal, el revelar u rollo fotográfico, al procesar alimentos, cuando en la atmósfera se combinan los óxidos del nitrógeno o del azufre con el agua, cuando sobre las fachadas de los edificios cae la lluvia ácida.
Ocurre una reacción química cuando unas sustancias iniciales (reactivas) se transforman en otras (productos) que tienen diferentes propiedades físicas y químicas.
Manifestaciones de una reacción química:
· CAMBIO DE COLOR: Unos ejemplos de esto es cuando al cocinar un pastel, hay un cambio de coloración debido a las reacciones que ocurren en los ingredientes al ser horneados. Los metales que se dejan expuestos a la intemperie, sufren un cambio de coloración al formarse en su superficie u oxido, producto de la reacción entre el metal y el oxígeno del aire.
Esta es la reacción más común y por ende dejamos claro que es la reacción que obtuvimos en el laboratorio, ya que se obtuvo cuando la fenolftaleína provoco un cambio de color en nuestra solución.
REACCIONES ÁCIDO-BASE:
Desde la antigüedad se clasifico a un tipo de sustancias como ácido y a otro como bases. La palabra ácido viene del latín ACIDUS, que significa agrio. La palabra ÀLCALI (base) que significa “cenizas de plantas”, ya que calcinando plantas se obtiene como residuo carbonato de potasio, que es una sustancia básica.
Se puede describir cualitativamente a los ácidos diciendo que tienen sabor agrio y que cambian el tornasol de azul a rojo. Reaccionan con algunos metales como el hierro, el magnesio y el Zinc. Produciendo hidrógeno gaseoso y provocan la descomposición de los carbonatos y bicarbonatos, liberando dióxido de carbono. Por su parte, las bases o álcalis tienen un sabor amargo y cambian el tornasol de rojo a azul. Al contacto con la piel, las bases se sienten jabonosas.
Y tal vez lo más importante, al poner en contacto un ácido con una base, las propiedades características de cada una de ellas se pierden, diciéndose que se NEUTRALIZAN.
UNIDADES DE CONCENTRACIÓN

La normalidad es la relación entre los equivalentes de una sustancia y los litros de una solución. Los equivalentes se refieren a las cargas por mol de una sustancia: para el caso de los ácidos se refiere a la cantidad de cargas de los hidronio H+, para las bases a la cantidad de cargas negativos de los grupos hidroxilo OH- y para las sales se refiere a las cantidades positivas de los elementos metálicos que sustituyen los hidrógenos de los ácidos.
DISOLUCIONES:
una disolución en una mezcla homogénea en donde una sustancia llamada SOLUTO está dispersa uniformemente en otra que se conoce como disolvente. El soluto está compuesto por partículas del tamaño de los átomos o las moléculas.
MORALIDAD: Es una medida que indica la cantidad de sustancia (en moles de soluto) que hay en un litro de disolución, a una cierta temperatura.
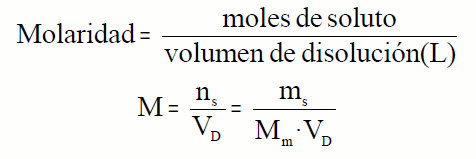
PH: el PH de una disolución es el menos logarítmico de la concentración de iones H+. El valor del PH está relacionado con la concentración de iones H+ que hay en una disolución, con la ventaja de ser la más fácil de manejar que la concentración de H+.
MEDICIÓN DEL PH: existen diversas formas de conocer el PH de una disolución más rápida y económica es mediante un indicador colorido.
CONCLUSIONES:
- La titulación por método volumétrico permite evaluar la concentración desconocida del ácido acético (CH3COOH) a través de la concentración ya conocida del hidróxido de sodio (NaOH), es decir, lado la cantidad de dicha base necesaria para reaccionar cuantitativamente con esa disolución ácida.
El punto final de la titulación es llamado es llamado punto de equilibrio que puede conocerse gracias a los indicadores, los cuales pueden variar sus concentraciones físicas dependiendo del tipo de solución presente.
Al tener conocimiento de la concentración desconocida, se determina el porcentaje masa / volumen.
El punto final la titilación se puede determinar cualitativamente uniendo las soluciones de ácido acético e hidróxido de sodio hasta producirse el color rozado pálido, en donde se encuentran cantidades iguales de equivalentes de ácido y base
DONDE ESTA LO DE YENKA
ResponderEliminar3.5