LEY DE BOYLE Y LEY DE CHARLES
LEY DE BOYLE Y LEY DE CHARLES
MARÍA PAULA GARCÍA RODRIGUES

INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
AREA DE QUIMICA
IBAGUE
INTRODUCCIÓN
en este laboratorio demostraremos la ley de charles y la ley de boyle por medios de su experimentacion. el en laboratorio medimos magnitudes como volumenes y temperaturas por metodos experimentales para luegos er comparados con los valores que prodice la teoria. ademas determinamos experimentalmente el valor de cero absoluto por metodos graficos y no graficos.
tenido en cuenta lo hecho en el laboratorio nuestra principal conclusión es:en gas a presión constante el volumen es directamente proporcional a la temperatura. como sabemos la ley de charles y la ley de boyle es una de las bases mas importantes sabiendo que, la dilatación de una sustancia gaseosa contenida en un recipiente, puede observarse de forma controlada, sumergida el matraz en un baño de agua cuya temperatura puede variarse a volumen.
también en la practica se analizo un proceso isobárico, es decir, una transformación donde la presión se mantiene constante y donde el volumen de gas tiene una relación directamente proporcional a la temperatura.
MARCO TEÓRICO
LEY DE BOYLE
Es una muestra de gas a temperatura constante, la presión y el volumen son inversamente proporcionales entre si.
la presión ejercida por una fuerza química es inversamente proporcional a las masas gaseosas, siempre y cuando su temperatura se mantenga constante, si el volumen aumenta la presión disminuye y si la presión aumenta el volumen disminuye. la ley de boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen de el recipiente, cuando la temperatura es constante.
la presión ejercida por una fuerza química es inversamente proporcional a las masas gaseosas, siempre y cuando su temperatura se mantenga constante, si el volumen aumenta la presión disminuye y si la presión aumenta el volumen disminuye. la ley de boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen de el recipiente, cuando la temperatura es constante.
Ecuación: V1/V2 = P2/P1
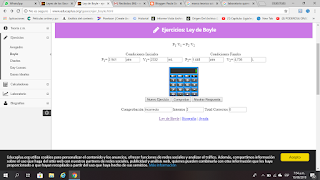
EJERCICIOS LABORATORIO LEY DE BOYLE
LEY DE CHARLES
el volumen de una muestra de gas a presión constante es proporcional a su temperatura en la escala kelvin.
en esta ley charles dice que por una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen de el gas aumenta y disminuye la temperatura, el volumen de el gas disminuye. esto se debe a que la temperatura esta directamente relacionada con la energía cinética debido al movimiento de las moléculas de el gas, así que por cierta cantidad de gas aúna presión dada a mayor velocidad de las molecular, mayor volumen de el gas.
V= constante* temperatura
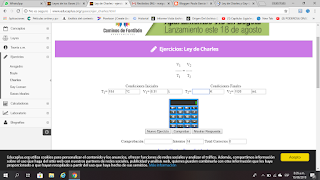
EJERCICIOS LABORATORIO LEY DE CHARLES
CONCLUSIONES
- El comportamiento de un gas con respecto a la temperatura es lineal
- teóricamente la arena debe tener el volumen de el agua que desplazo, en el establecimos que la ley de charles comprueba que el volumen de un gas es directamente proporcional a su temperatura absoluta, asumiendo que la presión se mantiene constante
- si un sistema se mantiene a presión constante el aumento de temperatura conlleva a un aumento de volumen.



























FALTO MAS CONSULTA PARA MARCO TEORICO Y NO TIENE LOS EJERCICIOS 3.0
ResponderEliminar